 预览加载中,请您耐心等待几秒...
预览加载中,请您耐心等待几秒...

1/10

2/10

3/10

4/10

5/10

6/10

7/10
8/10

9/10

10/10
亲,该文档总共28页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
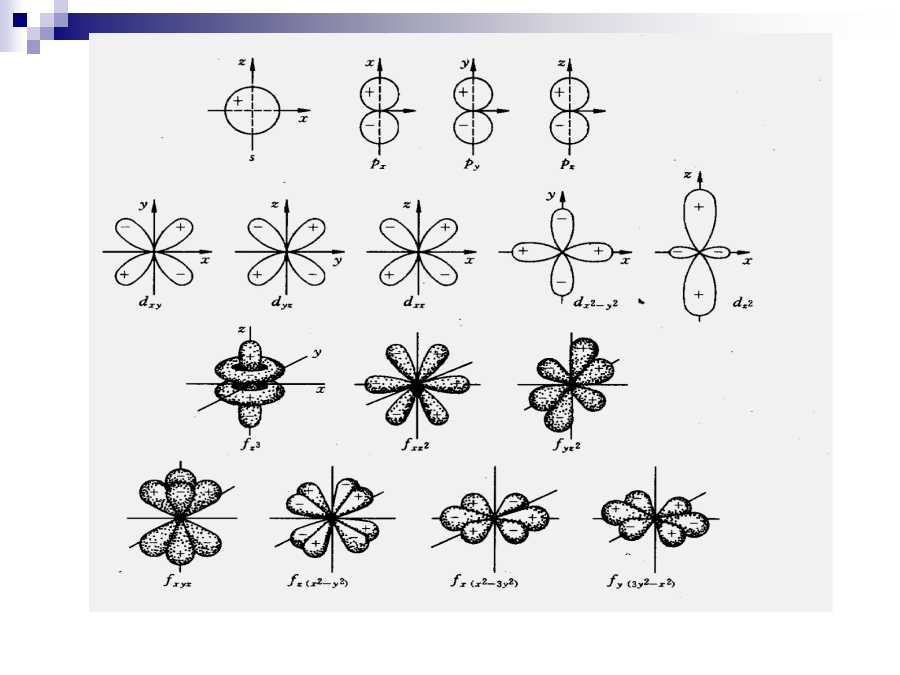
第二章化学基础知识第一节物质的结构组成及其存在形式——认识物质世界的基础各种各样的物质组成了五彩缤纷的世界,千差万别的分子组成了万事万物。这一切都是由原子开始的。本节从物质最基本的组成基元—原子开始,论述原子如何形成分子、分子和原子如何组成物质,以及物质的存在形式及性质。一·原子结构原子是组成世界上万事万物最基本的单元。原子是由原子核和核外电子组成的。当一种物质变为另一种物质时,原子核不发生变化,只有核外电子的分布及运动状态发生变化。原子核在核反应中可发生变化,这时一种元素的原子会变成另外一种元素的原子。原子核又是由质子和中子组成的,中子不带电荷,每个质子带一个单位的正电荷。每个核外电子带一个单位的负电荷。每个原子中质子所带的正电荷数和核外电子所带的负电荷数相等,也就是说每个原子中的质子数(又叫核电荷数)和核外电子数相等,所以整个原子是电中性的。小。l决定着同一能层中不同轨道能量的大小,因而常称为副量子数。l的取值可为0、1、2、3…,常分别用相应的光谱符号s、p、d、f…来标记。当n相同时,l数值越大的状态,能量越高;(3)磁量子数(m):m值描述了电子云的伸展方向,角量子数为l的电子在外磁场中会有不同的取向,它在磁场方向上的分量由m决定。m取值范围为0、士1、士2…士l;(4)自旋量子数(ms):电子除了绕核作空间的运动外,还存在着自旋运动。用自旋量子数ms描述电子的自旋运动,ms取值只能是1/2或-1/2,这表示电子有两种不同的自旋方向。这4个量子数完全确定了,相应电子的运动状态便确定了。原子结合成物质时所涉及的化学变化的实质是这些电子运动状态的变化,原子处于基态时,其核外电子的排布遵循三条重要原则:(1)泡利不相容原理(:一个原子轨道最多只能容纳两个自旋相反的电子,或者在一个原子中不可能存在4个量子数完全相同的两个电子;(2)能量最低原理:在不违背泡利原理的条件下,电子优先占据能量较低的原子轨道,即电子按低能轨道顺序向高能轨道逐一填充,使整个原子体系能量处于最低状态;(3)洪特规则:在能量相等(等价)的轨道上电子尽可能以相同的自旋方向分占不同的轨道;当等价轨道上电子处于全充满、半充满时,原子能量较低,比较稳定。二、元素周期律元素的性质主要由元素原子结构特征(核外电子排布,核电荷数和原子半径)所决定。根据原子核外电子排布规律及性质变化规律,将元素按一定规则排列,就形成了元素周期表。周期表中横向分7个周期,纵向分18个族,所有元素在周期表各就各位,排列有序。根据元素在周期表中的位置可推知关于元素的许多重要性质,这位人们认识元素、操作原子带来了极大方便。1.原子最外层电子排布2.原子半径4.金属性与非金属性元素的金属性与非金属性是指其原子在化学反应中失去或得到电子的能力。离子键当电负性大的非金属原子遇到电负性小的金属原子时,非金属原子会得到电子变为负离子,而金属原子会失去电子变为正离子,然后通过异性离子的静电引力形成分子。原子间的这种结合作用称离子键,由离子键所形成的化合物叫离子型化合物。因为每个离子都尽可能多地从不同方向吸引异性离子,所以离子键既无方向性又无饱和性,共价键具有饱和性,即两原子中自旋相反的电子配对后,不能再与第三个原子配对。共价键还具有方向性,当两原子相互靠近成键时,将尽可能采用电子云重叠最大的方向。共价键还具有多种成键方式:当种成键方式:当两个原子的价键轨道以“头碰头”方式重叠时,形成的键叫σ键,当两个原子的p价键轨道以“肩并肩”方式重叠时,形成的键叫π键,当两个原子的d价键轨道以“面对面”方式重叠键时,形成的键叫δ键。各种成键方式见图2-2。一般共价单键由σ键和一个π键构成,双重键键由一个σ键和一个π键构成,三重键由一个σ键和两个π键构成。图2-2σ键(a)、π键(b)与δ键(c)电子的共享方式3、分子轨道理论分子轨道理论理论认为分子中的电子在整个分子的势场中运动,因此它属于整个分子,用分子轨道来描述。四、分子间作用力1.范德华力在以上讨论的离子键、共价键和金属键中,原子间都存在较强的作用力。物质在形成过程中,除了这种原子间的强作用力外,在分子之间还存在较弱的作用力。这种力随着分子的类型、结构、分子量的不同而不同,它决定着物质的熔点、沸点、溶解度、粘度等物理性质。由于范德华(VanderWaals,1910年获诺贝尔物理奖)第一个提出分子间的这种作用力,故该力称范德华力。因此它还可以吸引另一分子中电负性大的原子Y,形成分子间的键:X—H---Y。2、液体(3)沸腾因为蒸发是吸热过程,所以升高温度有利于蒸发,故蒸气压随温度的升高而增大。当液体蒸气压随温度升高而增加到与外界压力相等时,液体就会沸腾,此时的温度就是液体的沸点。液体沸腾时,气化过程在整个液体中进行,(1)晶体与非晶体晶体






















