预览加载中,请您耐心等待几秒...
预览加载中,请您耐心等待几秒...

1/10

2/10

3/10

4/10
5/10

6/10

7/10

8/10

9/10

10/10
亲,该文档总共29页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
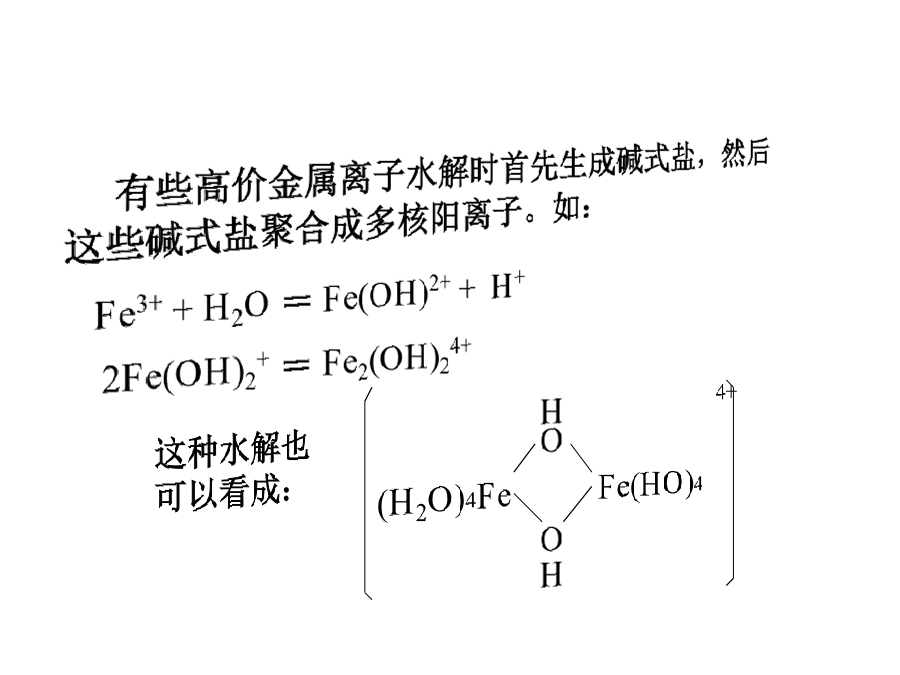
第一章元素周期性§6无机化合物的水解1.水解的产物1.2酸和碱式盐有些高价金属离子水解时首先生成碱式盐,然后这些碱式盐聚合成多核阳离子。如:1.3两种酸由于As(Ⅲ),P(Ⅴ)的金属性很弱,与OH-的结合力很强,因此这类反应很彻底,即使加入盐酸也很难抑制。高价金属盐类的水解,也属于这类情况,因为价态高时金属性减弱,如:1.4生成配位化合物2.影响水解的因素※水解产物也与极化能力有关:2.2原子轨道的空间效应3.常见氯化物的水解作用非金属氯化物,除CCl4和NCl3外均强烈水解生成二种酸:SiCl4+4H2O=H4SiO4+4HClPCl3+3H2O=H3PO3+3HClNCl3的水解产物是一种酸和一种碱:NCl3+3H2O=NH3+3HOClCCl4难水解。易水解氯化物及水解产物:关于主族元素氯化物的水解大致可归纳出以下几条规律:④温度对水解反应的影响较大,是主要的外因,温度升高时水解加剧。⑥水解反应也常伴有其他反应,如配合:3SnCl4+3H2OSnO2·H2O+2H2SnCl64.根据水解机理可以判断水解产物这一过程首先需要中心原子有可提供使用的空轨道(在这里,Si的空轨道是d轨道,C无d轨道,不具备该条件)。水解过程还包括了构型转变(sp3→sp3d→sp3d2→……)、键的生成与消去的能量变化过程。※NCl3是中心原子具有孤电子对的例子,发生的是亲电水解反应。首先由水分子上的氢进攻中心N原子上的孤对电子,生成Cl3N…H…OH,然后再发生键的断裂与消去的能量变化过程。※PCl3是中心原子既有空轨道(d轨道,可以接受孤对电子进攻)又有孤电子对(可以接受质子的亲电进攻),加上PCl3中配位数仅为3,远远未达到第三周期最大的配位数6这一数值,所以PCl3可以同时发生亲核水解和亲电水解反应:PCl3+3H2O=H3PO3+3HCl※NF3的分子结构与NCl3同,其中N原子也是采用sp3杂化轨道成键,其上有一对孤对电子。然而:①.由于F原子的电负性较大,使得NF3的碱性(给电子性)比NCl3小,因而亲电水解很难发生;②.由于N是第二周期元素,只有4条价轨道(没有d轨道),不可能有空轨道接受水的亲核进攻;③.N-F键的键能比N-Cl键的键能大,容易断裂.这些原因决定了NF3不会发生水解作用。综上可见,在涉及卤化物的水解时,除了要考虑热力学因素外,通常还要注意卤化物中心离子的结构和特征。如属于第几周期?最大配位数为几?有无孤对电子?有无空轨道?发生什么机理的水解?水解过程能量的变化即键能大小?有无动力学控制因素?等。当Na2CO3溶液作用于FeCl3溶液时,为什么得到得是Fe(OH)3而不是Fe2(CO3)3?如何解释As2O3在盐酸中的溶解度随酸的浓度增大而减小后有增大的原因。§5单质及主族元素化合物的性质及周期性递变规律§6无机化合物的酸碱性周期反常现象(PeriodicAnomalies)