预览加载中,请您耐心等待几秒...
预览加载中,请您耐心等待几秒...

1/10
2/10
3/10
4/10
5/10

6/10

7/10

8/10
9/10

10/10
亲,该文档总共46页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
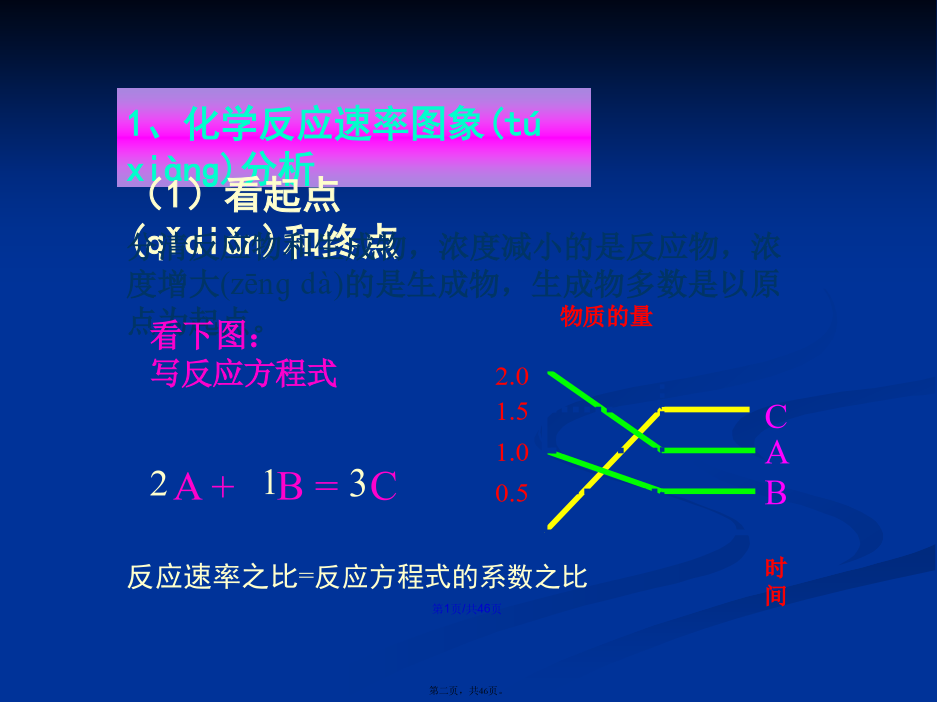
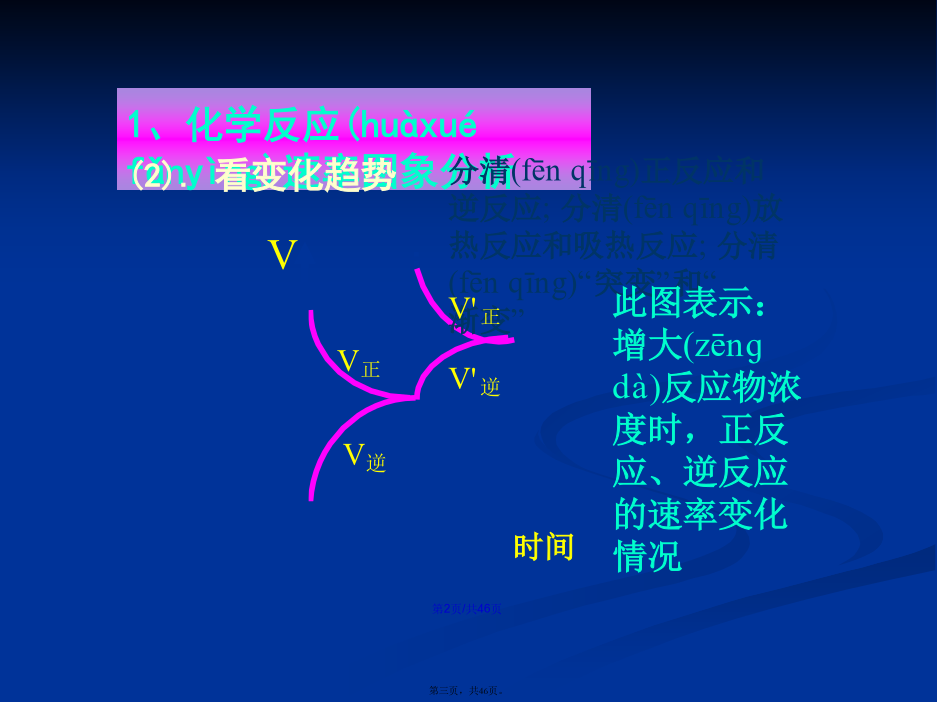
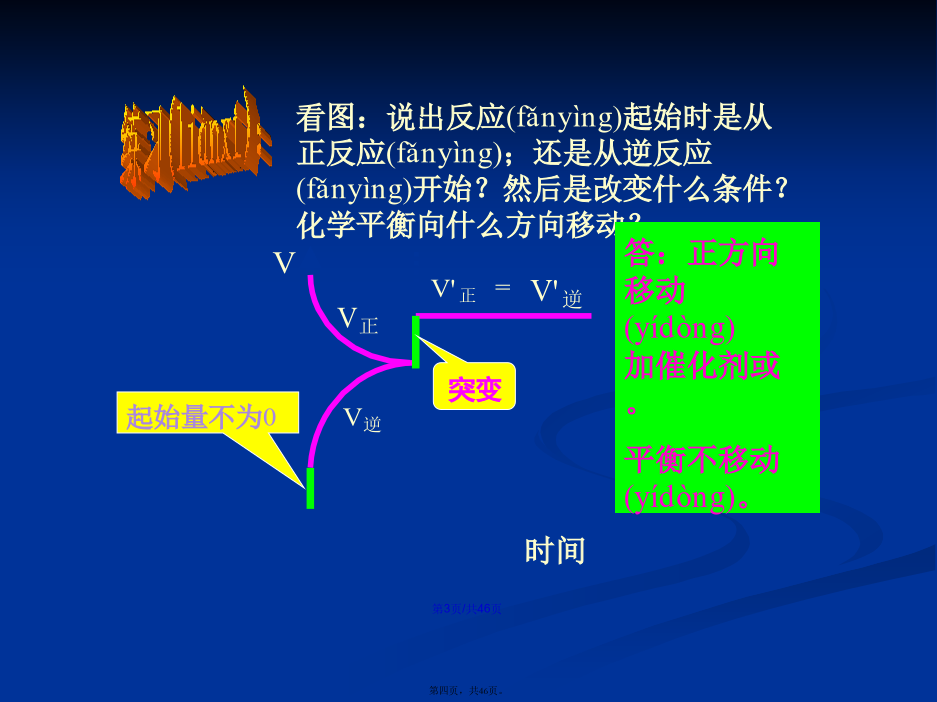
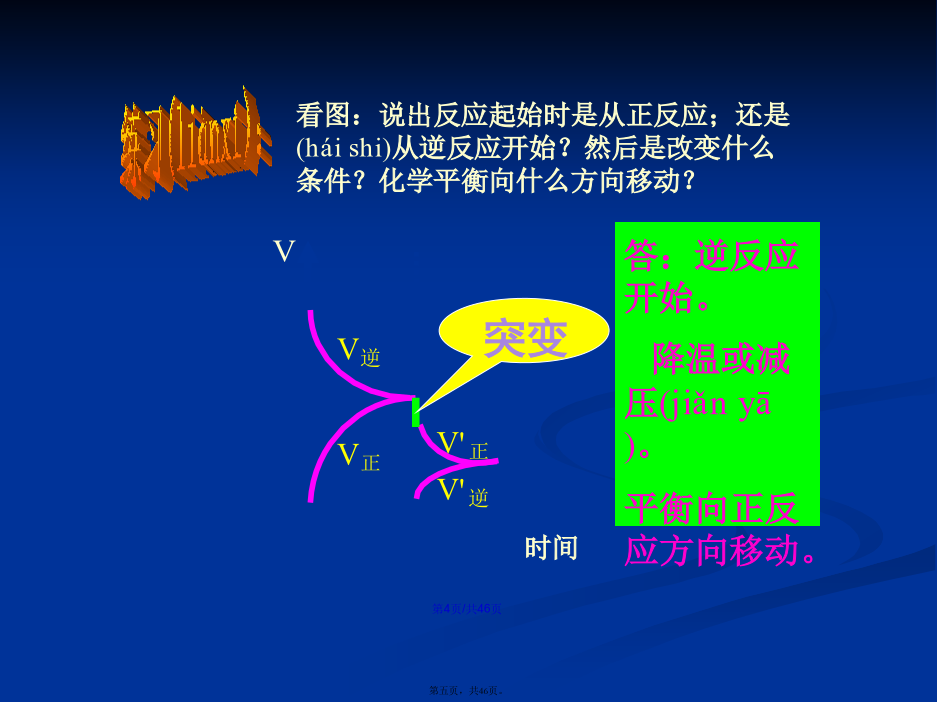
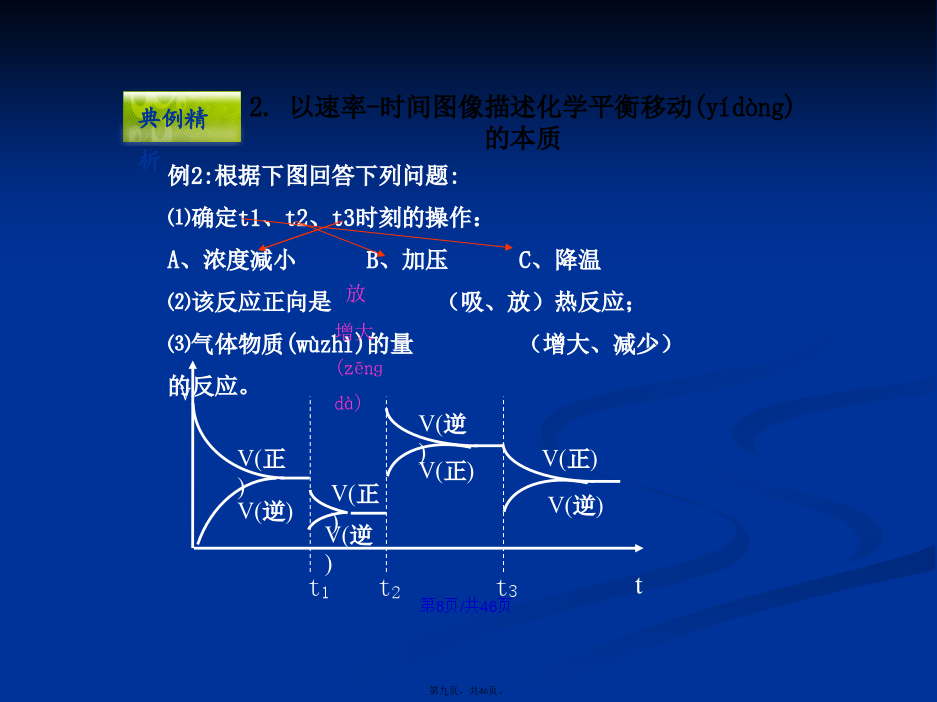
会计学1、化学反应速率图象(túxiànɡ)分析1.解题(jiětí)思路2.原则(1)“定一议二”原则在化学平衡图像中,包括(bāokuò)纵坐标、横坐标和曲线所表示的三个量,确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后,讨论横坐标与曲线的关系。(2)“先拐先平,数值大”原则在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高或表示的压强较大。2、如图所示,图中a曲线表示X(g)+Y(g)2Z(g)+W(s)+Q的反应过程,若使a曲线变为b曲线,可采取的措施是()反应X(g)+Y(g)2Z(g);△H<0,在一定条件下,反应物Y的转化率与反应时间(t)的关系如右下图所示。若使曲线a变为曲线b可采取的措施是A加催化剂B降低(jiàngdī)温度C增大压强D增大Y的浓度图中表示外界条件(T、P)的变化对下列反应的影响:L(s)+G(g)2R(g);△H>0,y轴表示的是(A)平衡时,混合气中R的百分(bǎifēn)含量(B)平衡时,混合气中G的百分(bǎifēn)含量(C)G的转化率(D)L的转化率A.达平衡后,若升温,平衡右移(yòuyí)B.化学方程式中m+n>e+ƒC.达平衡后,加入催化剂,则C%增大D.达平衡后,增加A的量有利于平衡向右移(yòuyí)动课堂作业•对于(duìyú)反应mA(g)+nB(g)pC(g)+qD(g)对于(duìyú)反应mA(g)+nB(g)pC(g)+qD(g)根据下图推断:正反应为反应,m+np+q在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L此反应符合下面图像,下列叙述是正确的是A正反应吸热,L是气体B正反应吸热,L是固体(gùtǐ)C正反应放热,L是气体D正反应放热,L是固体(gùtǐ)或液体第二(dìèr)课时////已知反应:3A(g)+B(g)C(s)+4D(g)下图中a、b表示一定条件下,D的体积分数随时间t的变化情况,若要使曲线b变为曲线a,可采取的措施是()增大B的浓度升高反应温度缩小反应容器的体积加入催化剂五.基本(jīběn)题型1.下图表示外界条件(温度、压强)的变化对下列反应的影响A(s)+B(g)2C(g),在图中,Y轴是指()A.平衡(pínghéng)混合气体中C的体积分数B.平衡(pínghéng)混合气体中B的体积分数C.B的转化率D.A的转化率题型2:由图像(túxiànɡ)特征判断方程式题型3:根据图像特征判断物质(wùzhì)的状态和反应特征练习(liànxí):B3.在容积固定为2L的密闭容器中充入X、Y各2mol,发生反应:X(g)+2Y(g)2Z(g)达到平衡时,以Y的浓度改变表示的关系如下图所示:回答下列问题:(1)用S表示面积,如Obd的面积可表示为S(Obd),则S(abdO)表示的意义是:_________________________________________________。(2)平衡时Y的物质的量浓度可表示为:_____________mol/L。(3)平衡时生成Z的物质的量可表示为_________mol。题型5:化学反应(huàxuéfǎnyìng)速率与化学平衡的综合运用练习(liànxí):五、其它(qítā):下列(xiàliè)反应符合下图T-v变化曲线的是A.4NH3(g)+5O2(g)4NO(g)+6H2O(g);ΔH<0B.N2O3(g)NO2(g)+NO(g);ΔH>0C.3NO2(g)+H2O(l)2HNO3(aq)+NO(g);ΔH<0D.2CO(g)CO2(g)+C(s);ΔH<04.对于反应N2+3H22NH3,测得NH3%与温度T的关系如图所示。请判断(pànduàn)该反应的正反应是_____热反应(填“放”或“吸”),并解释为什么在T1时NH3%最高?由体积分数—温度图像判断(pànduàn)平衡进程由体积分数(fēnshù)—温度图像判断平衡进程